Kaliumcarbonat (Potassium carbonate): Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Jenni (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 1: | Zeile 1: | ||
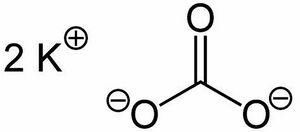
'''Kaliumcarbonat''' ist eine anorganische Verbindung, die aus den Elementen Kalium, Kohlenstoff und Sauerstoff besteht. Die chemische Formel lautet K2CO3 und die molare Masse beträgt 138,206 g/mol. | |||
[[File:Kaliumcarbonat_jepg.jpg|thumb|Kaliumcarbonat Summenformel]] | |||
Kaliumcarbonat | |||
== Eigenschaften == | |||
Kaliumcarbonat kommt in Form von farblosen, hygroskopischen Kristallen oder als weißes, geruchloses Pulver vor. Die Verbindung ist löslich in Wasser und wird auch in Alkohol gelöst. Die wässrige Lösung von Kaliumcarbonat ist alkalisch und hat einen pH-Wert von etwa 11. | |||
== Verwendung == | |||
Kaliumcarbonat wird in verschiedenen Anwendungen verwendet, darunter: | |||
als Katalysator bei der Herstellung von Polypropylen | |||
in der Lebensmittelindustrie als Säureregulator und Stabilisator | |||
in der Glasindustrie als Schmelzmittel | |||
in der Medizin zur Behandlung von saurem Urin und Hyperkalzämie | |||
in der Feuerwerksindustrie zur Erhöhung der Brennbarkeit | |||
== Sicherheitshinweise == | |||
Kaliumcarbonat ist in großen Mengen toxisch und kann bei Haut- und Augenkontakt sowie bei Einatmen zu Reizungen führen. Es ist wichtig, beim Umgang mit der Verbindung angemessene Schutzkleidung zu tragen und sicherzustellen, dass der Arbeitsplatz gut belüftet ist. | |||
== Quellen == | |||
#[https://www.chemie.de/lexikon/Kaliumcarbonat.html Chemie.de] | |||
#[https://de.wikipedia.org/wiki/Kaliumcarbonat Wikipedia] | |||
#[https://www.uv.es/webgidai/Experiments_Equipments_Units/EAAU_Equipments/CS28.pdf University of Valencia] | |||
Aktuelle Version vom 5. April 2023, 15:43 Uhr
Kaliumcarbonat ist eine anorganische Verbindung, die aus den Elementen Kalium, Kohlenstoff und Sauerstoff besteht. Die chemische Formel lautet K2CO3 und die molare Masse beträgt 138,206 g/mol.
Eigenschaften
Kaliumcarbonat kommt in Form von farblosen, hygroskopischen Kristallen oder als weißes, geruchloses Pulver vor. Die Verbindung ist löslich in Wasser und wird auch in Alkohol gelöst. Die wässrige Lösung von Kaliumcarbonat ist alkalisch und hat einen pH-Wert von etwa 11.
Verwendung
Kaliumcarbonat wird in verschiedenen Anwendungen verwendet, darunter:
als Katalysator bei der Herstellung von Polypropylen in der Lebensmittelindustrie als Säureregulator und Stabilisator in der Glasindustrie als Schmelzmittel in der Medizin zur Behandlung von saurem Urin und Hyperkalzämie in der Feuerwerksindustrie zur Erhöhung der Brennbarkeit
Sicherheitshinweise
Kaliumcarbonat ist in großen Mengen toxisch und kann bei Haut- und Augenkontakt sowie bei Einatmen zu Reizungen führen. Es ist wichtig, beim Umgang mit der Verbindung angemessene Schutzkleidung zu tragen und sicherzustellen, dass der Arbeitsplatz gut belüftet ist.